Desde el ISCIII mostramos nuestra solidaridad con todas las personas afectadas por el desastre de la DANA
Todo nuestro apoyo en estos momentos tan difíciles
Actualidad

El Centro Nacional de Microbiología renueva la acreditación de la OMS como laboratorio nacional de referencia en sarampión y rubeola
El Centro Nacional de Microbiología (CNM) del Instituto de Salud Carlos III (ISCIII) ha sido reacreditado por la Organización Mundial de la Salud (OMS) como Laboratorio Nacional de Referencia para Sarampión y Rubeola. El citado laboratorio forma parte de la Red Global de Laboratorios de Sarampión y Rubeola que la OMS tiene repartida por todo el mundo. La Comisión Regional Europea de Verificación de la Eliminación de Sarampión y Rubeola (RVC) certificó en 2016 la situación de eliminación de rubeola en España, y en 2017 del sarampión, tras 36 meses consecutivos sin circulación endémica de los virus. Esta Comisión evalúa anualmente la situación de nuestro país, con arreglo al informe que envía el Comité Nacional de Verificación, y que se realiza con la participación del Ministerio de Sanidad y el ISCIII, a través de su Centro Nacional de Epidemiología y su Centro Nacional de Microbiología. Tanto el sarampión como la rubeola siguen consideradas como eliminadas en nuestro país, en un contexto global de aumento de la incidencia del sarampión en muchas zonas del mundo. En 2024 se registró en la UE/EEE un incremento de casos 10 veces superior a la ocurrida en 2023, con más de 35.000 casos y un patrón típicamente estacional, algo que no ocurrió en años previos (2021-2023). En España se notificaron 227 casos confirmados de sarampión ese mismo año. Hasta agosto de 2025, en la UE/EEE se han notificado 7.155 casos de sarampión. En España, con datos provisionales hasta mediados octubre, se han notificado 351 casos este año. La Organización Mundial de la Salud (OMS) está instando a todos los países a reforzar la vacunación, con el fin de alcanzar y mantener la cobertura necesaria para interrumpir la transmisión de la enfermedad, una situación que ocurre cuando más del 95% de la población cuenta con las dos dosis recomendadas de la vacuna. Igualmente, las autoridades sanitarias insisten en mantener y reforzar las labores de vigilancia, para lo que es fundamental el trabajo de análisis de laboratorio y la adecuada integración con los datos epidemiológicos. En el ISCIII, estas labores se llevan a cabo, respectivamente y de manera coordinada, desde el Centro Nacional de Microbiología y desde el Centro Nacional de Epidemiología. El CNM del ISCIII actúa como laboratorio de referencia de la OMS, además de en sarampión y rubeola, en enfermedades como la gripe, la leishmaniasis o la polio, entre otras.
Saber más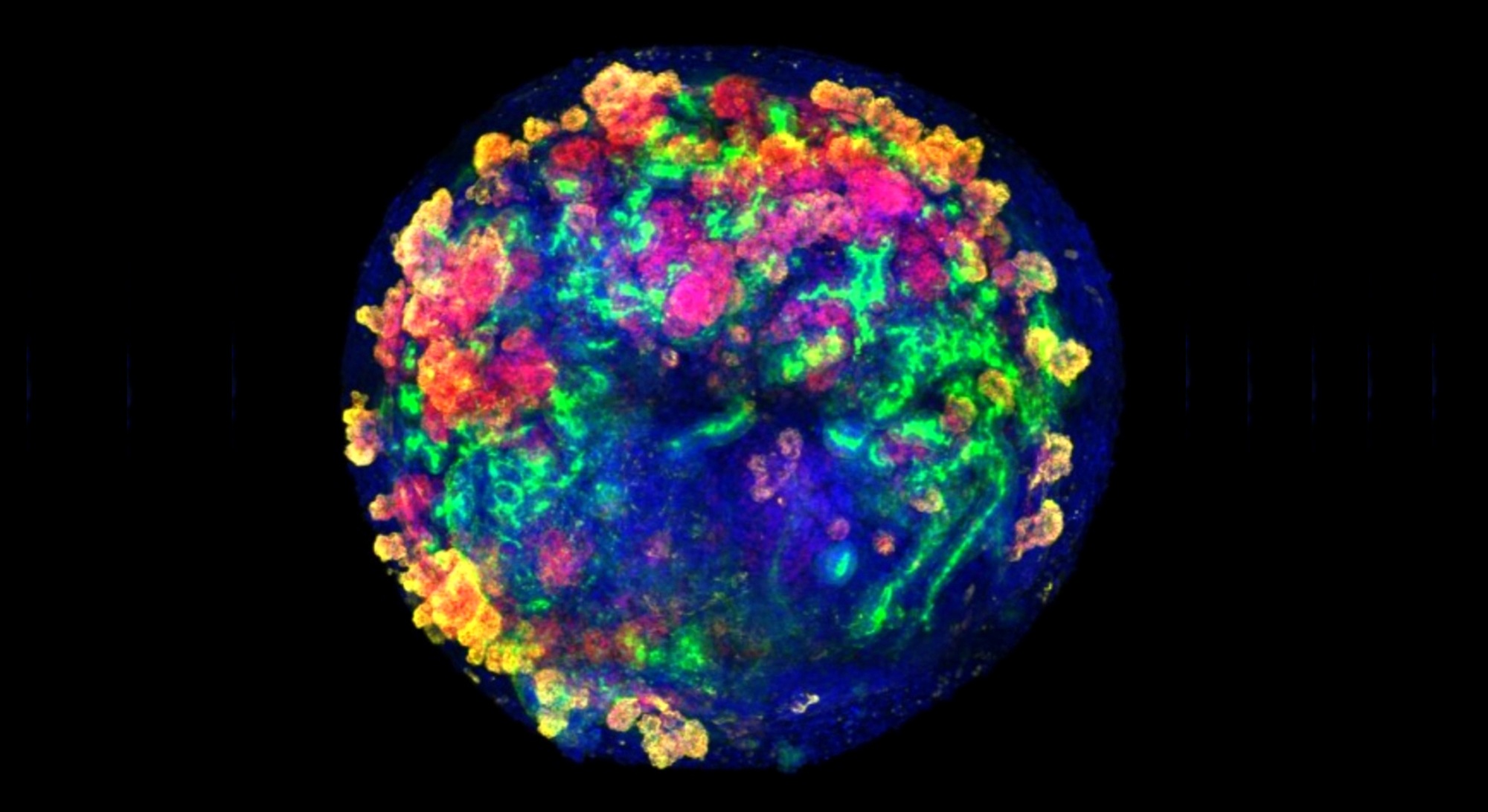
Primer autotrasplante en cerdos de riñones porcinos modificados con organoides humanos de riñón
Un equipo español liderado por el Instituto de Bioingeniería de Cataluña (IBEC), con participación del Instituto de Salud Carlos III (ISCIII) y grupos de investigación internacionales, ha desarrollado una tecnología pionera que permite producir organoides renales humanos -mini riñones fabricados en laboratorio- de manera escalable, introducirlos en riñones de cerdo y trasplantar el riñón de manera autóloga en el mismo animal, evaluando su viabilidad y funcionabilidad después del trasplante. • Articulo completo en este enlace El estudio, que se encuentra en fase preclínica, confirma la seguridad y viabilidad del procedimiento, abriendo la puerta a futuros ensayos en contextos clínicos -en pacientes-. A largo plazo, esta aproximación podría contribuir a alargar la vida útil de los órganos destinados al trasplante y ofrecer una alternativa terapéutica para enfermos renales crónicos. Un organoide de riñón es una estructura tridimensional, de unas micras de tamaño, cultivada en el laboratorio a partir de células madre humanas. Aunque no es un órgano completo, reproduce muchas de sus estructuras y funciones principales. Gracias a estas características, los organoides permiten estudiar cómo se desarrolla el riñón, probar nuevos fármacos y, en el futuro, se espera que puedan ser utilizados para reparar tejidos renales dañados o mejorar órganos destinados al trasplante. El estudio describe, por primera vez, un método sistemático y escalable de ingeniería genética para producir miles de estos organoides renales humanos. Los resultados son fruto del trabajo de más de una década dedicada a estudios de medicina regenerativa y bioingeniería de órganos. El equipo de investigación ha conseguido combinar por primera vez organoides renales humanos con riñones porcinos vivos, conectados a máquinas de perfusión normotérmica. El uso de estos dispositivos, utilizados habitualmente en el quirófano para mantener el órgano vivo y oxigenado fuera del cuerpo antes de un transplante, ha permitido insertar organoides humanos dentro de los riñones porcinos y evaluar en tiempo real su integración y función. El estudio, publicado en la revista Nature Biomedical Engineering, representa un hito en el campo de la medicina regenerativa y personalizada, estableciendo las bases para la utilización de organoides de riñón derivados de células madre humanas para terapia celular en ensayos clínicos. El trabajo está liderado por la doctora Núria Montserrat, investigadora ICREA en el IBEC, coordinadora de la Plataforma ISCIII de Biobancos y Biomodelos en el momento del estudio, y actual consejera del Departamento de Investigación y Universidades de Cataluña. Elena Garreta, investigadora senior del grupo de Puripotencia para la regeneración de órganos del IBEC y actual coordinadora de la Plataforma de Biobancos y Biomodelos del ISCIII, es co-primera autora del estudio, en el que ha participado el grupo de Jordi Cano en el Centro Nacional de Microbiología (CNM) del ISCIII. Además, también participan las Áreas de Bioingeniería y de Cáncer del Centro de Investigación Biomédica en Red (CIBER) del Instituto. Para la investigación se ha utilizado el biobanco nacional de células madre del ISCIII, que también ha impulsado el estudio aportando una financiación de más de 3,2 millones de euros a través de diferentes ayudas en convocatorias -Plataformas, Redes, grupos CIBER y contratos Sara Borrell- de la Acción Estratégica en Salud (AES). El investigador del ISCIII explica que desde el Centro Nacional de Microbiología “se han hecho los estudios inmunológicos que han determinado que los organoides humanos no inducen la respuesta inmunitaria en el receptor del trasplante. No hemos detectado efectos adversos ni inmunogenicidad, lo que supone que el uso de organoides para trasplantes es seguro”. Según añade Jordi Cano, hasta ahora sólo se habían llevado a cabo estudios en modelos experimentales de ratón y rata: “Combinar xenotrasplantes con organoides humanos es un hito. Producir organoides de riñón de manera consistente, a gran escala, utilizando un modelo de cerdo mas similar al humano y de manera asequible, acerca la posibilidad de futuros ensayos en personas”. A su juicio, se abre la puerta a un futuro de posibilidades, "en el que los organoides podrían ayudar a prevenir el rechazo en algunos trasplantes, reducir efectos secundarios en las terapias inmunosupresoras, y utilizar órganos de donantes que se actualmente descartan por no cumplir ciertas condiciones clínicas". Imágenes de los organoides humanos utilizados en el estudio para el autotrasplante con riñón de cerdo (IBEC). La autora principal del trabajo, la doctora Montserrat, explica que la investigación demuestra que la combinación de tecnologías de organoides y perfusión ex vivo puede permitir intervenciones celulares en condiciones totalmente controladas: "El objetivo a largo plazo es poder regenerar o reparar un órgano antes del trasplante. Esto podría reducir el tiempo de espera de los pacientes crónicos y aumentar el número de órganos viables para el trasplante." La doctora Elena Garreta, investigadora senior del grupo de Puripotencia para la regeneración de órganos del IBEC, co-primera autora del estudio y actual coordinadora de la Plataforma de Biobancos y Biomodelos del ISCIII, añade: "A pesar del gran potencial clínico de los organoides, hasta ahora uno de los grandes retos para aplicar esta tecnología en tratamientos médicos reales era producirlos de manera escalable, uniforme y asequible. Ahora, con nuestro nuevo método, podemos generar miles de organoides renales en condiciones controladas y en poco tiempo, con una gran precisión y sin necesidad de componentes complejos. Esto abre la puerta a aplicaciones como la detección de fármacos o el estudio de enfermedades”. Una tecnología escalable y segura: hacia la regeneración de órganos antes del trasplante La utilización de las máquinas mencionadas, para llevar a cabo la perfusión de los organoides dentro de los riñones, ofrece una ventaja clave: permite medir parámetros fisiológicos del órgano en tiempo real y detectar de manera inmediata cualquier signo de daño o rechazo. Los experimentos se realizaron tanto ex vivo (fuera del organismo) como in vivo (en el mismo animal), utilizando un modelo porcino de trasplante muy similar al riñón humano. El equipo de investigación observó que, después de 24 y 48 horas del trasplante, los organoides humanos persistían integrados en el tejido renal porcino, mantenían su viabilidad y no desencadenaban ninguna respuesta inmune significativa. El riñón trasplantado continuaba funcionando con normalidad, y no se detectaron signos de daño ni toxicidad. Esta metodología permite imaginar un escenario clínico en el que los órganos destinados al trasplante puedan ser tratados y acondicionados antes de implantarlos. En este contexto, la colaboración con el ISCIII, la Organización Nacional de Trasplantes (ONT), el Instituto de Investigación Biomédica de A Coruña (INIBIC y otras instituciones, ha sido esencial para trasladar la investigación a un entorno quirúrgico realista y preclínico. • Referencia del artículo: Elena Garreta, Daniel Moya-Rull, Alberto Centeno, Andrés Marco, Asier Ullate-Agote, Gaia Amato, Carlos J. Aranda, Roger Oria, Daniel Lozano-Ojalvo, Merel B. F. Pool, Tim L. Hamelink, Idoia Lucía Selfa, Federico González, Carolina Tarantino, Alejandro Montero Salinas, Patricia López San Martín, Priyanka Koshy, Aleix Gavaldà-Navarro, Amaia Vilas-Zornoza, Juan R. Rodríguez-Madoz, Antón Fernández García, Inmaculada Marquez-Leiva, Henri G. D. Leuvenink, Cristobal Belda-Iniesta, Maarten Naesens, Beatriz Dominguez-Gil, Marcelino González-Martín, Javier Rodríguez-Rivera, Jordi Ochando, Felipe Prosper, Cyril Moers & Nuria Montserrat. Systematic production of human kidney organoids for transplantation in porcine kidneys during ex vivo machine perfusion. Nature Biomedical Engineering (2025). DOI: 10.1038/s41551-025-01542-1.
Saber más
Nuevos avances en la identificación de biomarcadores en leishmaniasis visceral
Un grupo de investigación del Instituto de Salud Carlos III (ISCIII) ha publicado un artículo científico en el que describen la identificación de posibles biomarcadores de leishmaniasis visceral (LV) en pacientes afectados por esta enfermedad infecciosa. Los resultados del estudio se han publicado en la revista Frontiers in Immunology. La leishmaniasis visceral es la forma más grave de esta enfermedad parasitaria, que se caracteriza por una alta morbilidad y mortalidad, especialmente en pacientes con el sistema inmunitario debilitado. Esta enfermedad infecciosa desatendida está causada por protozoos de la familia Leishmania, se transmite principalmente a través de la picadura de flebotomos -que actúan como vectores del parásito- y se caracteriza por fiebre crónica, agrandamiento del bazo e hígado y pancitopenia. La investigación está coordinada por Eugenia Carrillo y Javier Moreno, del Centro Nacional de Microbiología (CNM) del ISCIII. En un trabajo anterior, su equipo ya había determinado en modelos animales que las vesículas extracelulares plasmáticas (EVs), estructuras con material genético y proteico liberadas por las células, representan una fuente prometedora de biomarcadores clínicos para esta enfermedad. En el estudio ahora publicado, se emplea una metodología similar a la del trabajo previo, pero aplicada al seguimiento clínico de pacientes humanos, gracias al análisis de muestras de pacientes de un brote epidemiológico de leishmaniasis ocurrido en Madrid hace años, que fueron almacenadas en el biobanco del CNM-ISCIII. Este trabajo con muestras de pacientes ha permitido dar un paso más hacia la aplicación clínica de la identificación de biomarcadores medidos con una prueba ELISA, uno de los test más utilizados en la clínica médica. El análisis de las EVs procedentes de suero de pacientes con LV permitió la identificación de 132 proteínas humanas diferencialmente expresadas entre pacientes activos -con enfermedad pero sin tratamiento- y tratados. Posteriores pruebas validaron mediante el test ELISA seis biomarcadores específicamente candidatos para detectar la leishmaniasis visceral. Entre ellos, destaca la detección de la proteína amiloide sérica A1 (SAA1), característica de la fase aguda de la enfermedad y cuya expresión disminuyó significativamente un mes después del tratamiento en pacientes afectados de la enfermedad. El equipo del ISCIII explica que esta proteína, asociada a procesos inflamatorios sistémicos, “se posiciona como un marcador pronóstico temprano, accesible y útil para el seguimiento clínico de la respuesta terapéutica en personas con leishmaniasis visceral”. Junto a la SAA1, el estudio identificó otras 29 proteínas de Leishmania en vesículas extracelulares humanas, “lo que representa una fuente novedosa de biomarcadores parasitarios para mejorar el diagnóstico, el seguimiento postratamiento y la comprensión de la dinámica de la infección”, concluyen los investigadores e investigadoras del ISCIII. Foto de grupo del equipo del CNM-ISCIII responsable de la investigación. En definitiva, estos hallazgos permiten distinguir entre infección activa e infección curada, y ofrecen herramientas potenciales para mejorar el seguimiento clínico y el desarrollo de nuevas estrategias diagnósticas y terapéuticas en esta enfermedad. • Referencia del artículo: Torres A, Montero-Calle A, Lozano-Rendal M, Sánchez C, Bernardo L, Solana JC, San Martin JV, Barderas R, Moreno J and Carrillo E (2025) Proteomics of plasma-derived extracellular vesicles from human patients identifies biomarkers for monitoring visceral leishmaniasis therapy. Front. Immunol. 16:1646335. doi: 10.3389/fimmu.2025.1646335. Noticias relacionadas: - Estudiar las vesículas extracelulares, vía prometedora en leishmaniasis visceral - Nuevos datos sobre la influencia de fármacos inmunosupresores en leishmaniasis visceral
Saber másServicios destacados
Área de Orientación Diagnóstica
Sistema de Respuesta Rápida
Eventos
-
21 may
El viaje de un científico. Del mundo académico a la industria.12:00h.Presencial: Aula 1, Edificio 53, Majadahonda -
07 jun
Sesión científica: ¿Podría la gripe aviar (H5N1) causar una nueva pandemia?18:00h.RANM, c/ Arrieta 12. Madrid
Empleo
SGSAFIPY 318/24-2 M3-1 M1-INDEFINIDO
Inicio de plazo: 11/06/2025
Fin de plazo: 24/06/2025
Clase de personal: Laboral
Procedimiento / Modalidad: Indefinido (Art. 23 bis LCTI)
MPY 240/23 -M2-INDEFINIDO
Inicio de plazo: 11/04/2025
Fin de plazo: 29/04/2025
Clase de personal: Laboral
Procedimiento / Modalidad: Indefinido (Art. 23 bis LCTI)
MPY 304/24 M1-INDEFINIDO
Inicio de plazo: 09/04/2025
Fin de plazo: 24/04/2025
Clase de personal: Laboral
Procedimiento / Modalidad: Indefinido (Art. 23 bis LCTI)






